Plastizität
Plastizität ist die Eigenschaft einzelner Synapsen, Nervenzellen und ganzer Gehirnareale sich in Abhängigkeit ihrer Nutzung zu verändern. Dies geschieht zum einen als Reaktion auf Verletzungen des neuronalen Gewebes, zum anderen ist es ein natürlicher Prozess, der es dem Organismus ermöglicht, auf Veränderungen in seiner Umgebung zu reagieren und sich diesen anzupassen. Plastizität ist damit die Grundlage aller Lernprozesse.
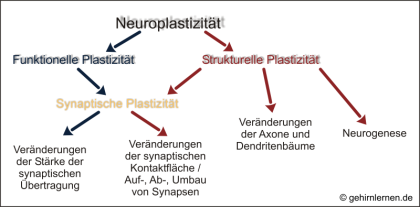
Dabei bezieht Plastizität verschiedene Stufen mit ein. Funktionelle Plastizität spielt sich auf der Ebene der Synapse, d.h. der Verbindungen zwischen Nervenzellen ab, wobei (lediglich) die Stärke der synaptischen Übertragung, d.h. die Menge des ausgeschütteten Botenstoffes oder die Rezeptordichte auf der Empfängerzelle, verändert wird. Man spricht hier auch von synaptischer Plastizität. Synaptische Plastizität kann darüber hinaus aber auch strukturelle Veränderungen bedingen. Von struktureller Plastizität spricht man, wenn die synaptische Kontaktfläche vergrößert oder verkleinert wird oder ganze Synapsen auf-, ab- oder umgebaut werden. Strukturelle Plastizität kann über die Synapse hinausgehen, wenn ganze Axone oder Dendritenbäume zurückgezogen und/oder in andere Richtungen ausgestreckt werden. Schließlich gehört auch die Bildung neuer Nervenzellen, die Neurogenese, die beim Menschen nur noch in zwei Gehirnarealen, dem olfaktorischen Bulb und dem Gyrus dentatus des Hippocampus zu finden ist, zur strukturellen Plastizität.
Als Entdecker der synaptischen Plastizität gilt Donald O. Hebb, der 1949 in seinem Buch The Organization of Behavior die so genannte Hebb’sche Lernregel formulierte:
„Wenn ein Axon der Zelle A […] Zelle B erregt und wiederholt und dauerhaft zur Erzeugung von Aktionspotentialen in Zelle B beiträgt, so resultiert dies in Wachstumsprozessen oder metabolischen Veränderungen in einer oder in beiden Zellen, die bewirken, dass die Effizienz von Zelle A in Bezug auf die Erzeugung eines Aktionspotentials in B größer wird.“
Anders formuliert heißt dies, je häufiger ein Neuron A gleichzeitig mit Neuron B aktiv ist, umso bevorzugter werden die beiden Neuronen aufeinander reagieren, kurz what fires together, wires together – was zusammen feuert, verbindet sich.
Die zugrunde liegenden molekularen Mechanismen hat in der Folge insbesondere der Neurobiologe Eric Kandel erforscht. Er konnte zeigen, dass plastische Vorgänge an Synapsen sowohl die Prä- als auch die Postsynapse betreffen können.
In der Präsynapse spielen dabei insbesondere andere Nervenzellen, so genannte Interneurone, eine Rolle, die ihre Synapsen nicht an den Dendriten, sondern an der Präsynapse bilden (axo-axonale Kontakte). Senden sie eine Erregung führt dies in der Präsynapse nicht zu einem Aktionspotential, sondern durch Anstoßung einer second-messenger-Kaskade zu einer veränderten Transmitterfreisetzung, indem z.B. die Beweglichkeit der Vesikel der Botenstoffe erhöht oder Kaliumkanäle blockiert werden, um die Länge der eigentlichen Signalübertragung zu erhöhen.
Dies ist möglich, da die Botenstoffe des Interneurons an der Präsynapse auf Rezeptoren treffen, die nicht an einen Ionenkanal gekoppelt sind, also keine Veränderung des Membranpotentials bewirken, sondern an Proteine gebunden sind, die den ersten Schritt in der Signalkaskade darstellen. Im Gegensatz zu den Ionenkanal-gebundenen, ionotropen, Rezeptoren, nennt man diese Rezeptoren metabotrop, weil sie eine metabolische, d.h. auf den Stoffwechsel ausgehende, Reaktion hervorrufen.
A) Das Interneuron bildet einen axo-axonalen Kontakt auf der Präsynapse einer erregenden Synapse und greift modulierend auf die Weiterleitung des Aktionspotentials (gelber Pfeil) ein.
B) Wird es selbst erregt, kommt es zum Einstrom von Ca2+ (gelb) in die Synapse und Botenstoff (rot) wird freigesetzt, der an der Membran der Präsynapse an metabotrope, G-Protein-gekoppelte Rezeptoren bindet. Dies aktiviert das G-Protein, das daraufhin ein Enzym namens Adenylatzyklase aktiviert, das die Spaltung von ATP zu zyklischem AMP (cAMP) katalysiert. cAMP ist der eigentliche second messenger, der wiederum die Proteinkinase A (PKA) aktiviert. Diese Kinase kann verschiedene Proteine phosphorylieren. Sie tut dies unter anderem mit Kalium-Kanälen (1), die daraufhin länger geöffnet bleiben und so ein verlängertes Aktionspotential ermöglichen. Zudem erhöht PKA die Beweglichkeit der Vesikel, so dass auf eine Erregung der Präsynapse hin vermehrt Botenstoff (grün) ausgeschüttet wird. Dies alles sind kurzfristige Prozesse im Rahmen einer Kurzzeitplastizität. Bei länger anhaltender PKA-Aktivität „wandert“ diese auch in den Zellkern (2) und aktiviert dort verschiedene Proteine und Genexpressionsfaktoren (z.B. CREB), wodurch eine Proteinbiosynthese zur Strukturveränderung der Synapse (Vergrößerung/Verkleinerung der Kontaktfläche, Auf-, Ab- und Umbau von Synapsen) eingeleitet wird (Langzeitplastizität).
In Abb. 12.2 ist (nur) ein Beispiel einer second-messenger-Kaskade dargestellt. Es gibt verschiedene G-Proteine (Gs, Go, Gq…), die unterschiedliche second messenger einbeziehen und damit unterschiedliche Signalkaskaden aktivieren. Das Grundprinzip der Auslösung von Kurz- und Langzeitplastizität ist dabei aber immer das gleiche.
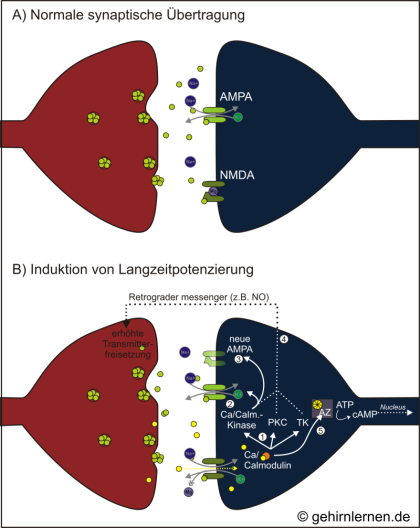
Bei der Plastizität der Postsynapse spielt der Botenstoff Glutamat eine entscheidende Rolle. Dieser hat auf der postsynaptischen Membran zwei verschiedene Rezeptortypen: zum einen die so genannten AMPA-Rezeptoren, ionotrope, d.h. Ionenkanal gebundene Rezeptoren, deren Aktivierung zur Depolarisierung der Postsynapse führen, zum anderen die NMDA-Rezeptoren, die metabotrope Rezeptoren sind. Unter „normalen“ Umständen ist ein NMDA-Rezeptor durch Magnesium (Mg2+) blockiert. Wird die Membran jedoch kurz hinter einander mehrfach depolarisiert, z.B. durch zwei kurz hintereinander eintreffende Reize, so löst sich die Mg2+-Blockade und zusätzliches Ca2+ kann einströmen. Dieser zusätzliche Ca2+-Einstrom führt zu einer Prozesskaskade, die als Langzeitpotenzierung (LTP – long-term potentiation) bezeichnet wird und an deren Ende die Synthese von Proteinen und die Umwandlung der gesamten Synapse stehen können.
A) Während einer normalen synaptischen Übertragung bindet Glutamat (grün) sowohl an AMPA-als auch an NMDA-Rezeptoren. Da der AMPA-Rezeptor ein Ionenkanal gebundener Rezeptor ist, erlaubt er nach Bindung von Glutamat den Einstrom von Na+- und den Ausstrom von K+-Ionen. Die Membran wird depolarisiert. Der NMDA-Rezeptor aber ist durch Magnesium (Mg) blockiert, so dass über ihn kein Ionenaustausch stattfinden kann.
B) Die gleichzeitig oder kurz aufeinander folgende Stimulation der Postsynapse hingegen führt zu Prozessen, die als Langzeitpotenzierung bezeichnet werden. Durch die Depolarisation der Membran ausgelöst durch die Aktivierung der AMPA-Rezeptoren löst sich die Mg-Blockade der NMDA-Rezeptoren. Ionen können passieren. Neben Na+ und K+ gehört hierzu auch Ca2+. Ca2+ bindet in der Zelle nun an Calmodulin. Dieser Komplex (in der Abb. gelb-oranger Komplex) aktiviert die Ca-Calmodulin-Kinase, die Proteinkinase C (PKC) und die Tyrosinkinase (TK) (1). Die Ca-Calmodulin-Kinase phosphoryliert AMPA-Rezeptoren, die damit empfindlicher für den Botenstoff Glutamat werden (2). Zudem regt sie die Bildung neuer AMPA-Rezeptoren an (3). Alle drei Kinasen bewirken die Bildung eines retrograden messengers (4), eines Botenstoffes, der zurück an die Präsynpase gesendet wird, um auch hier Veränderungen im Sinne einer Steigerung der Botenstoffausschüttung zu erreichen. Schließlich, in der späten Phase der LTP, wird durch den Ca-Calmodulin-Komplex auch die Adenylatzyklase aktiviert (5), die die Umwandlung von ATP in cAMP katalysiert, welches wiederum zum Kern wandert, um dort die Proteinbiosynthese zur Strukturveränderung der Synapse anzuregen.
NMDA-Rezeptoren finden sich größter Dichte im Hippocampus, einer der wichtigsten Regionen für den Transfer von Gedächtnisinhalten vom Kurz- in das Langzeitgedächtnis, aber auch in der Amygdala und dem Cortex.
Gäbe es nur LTP, wären die Zellen bald gesättigt, d.h. das Maximum an möglicher Übertragungseffizienz wäre erreicht. Ginge dies allen Zellen so, würde die Bedeutung aus den Nervennetzen verloren gehen. So gibt es zu LTP auch einen gegensteuernden Mechanismus, die Langzeitdepression (LTD – long-term depression), die die Übertragungseffizienz mindert. Damit trägt sie auch dazu bei, den relativen LTP-Effekt an Nachbarzellen zu erhöhen, indem sie den Kontrast (signal-to-noise contrast) verstärkt (weiß leuchtet besser auf schwarz als auf grau).
LTD tritt auf, wenn entweder die Prä- oder die Postsynapse erregt wird, aber niemals beide. In der Präsynapse kann z.B. eine Aktivierung auftreten, die zu schwach ist, um zur Postsynapse übertragen zu werden. Die Postsynapse wiederum kann – ohne dass eine Aktivierung der Präsynapse vorausgegangen wäre – durch andere Nervenzellen erregt werden, oder am Axon kann ein Aktionspotential ausgelöst werden, das das in den Dendriten zurückstrahlt.
Erstaunlicherweise sind die molekularen Vorgänge, die LTP und LTD auslösen sehr ähnlich und noch Gegenstand aktueller Forschung. Bei Interesse können Sie hier eine Forschungsarbeit dazu anschauen.
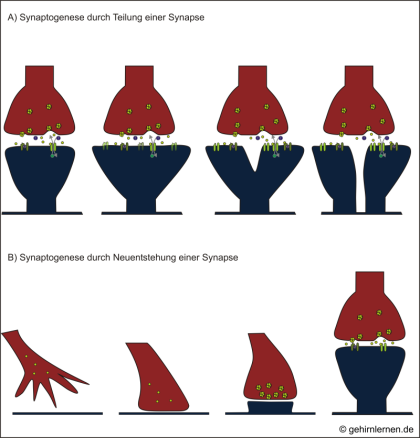
Auf struktureller Ebene bewirkt Langzeitplastizität den Umbau und Aufbau neuer Synapsen (Synaptogenese). Dabei können sich bereits vorhandene Synapsen aktivitätsabhängig teilen, um eine neue Synapse zu bilden (Abb. 12.4, A), oder auswachsende Axonendigungen, so genannte Wachstumskegel, können die Bildung ganz neuer synaptischer Kontakte anregen (Abb. 12.4, B). Im Gegenzug können dafür an anderer Stelle nicht oder weniger genutzte Synapsen abgebaut werden. Auch ganze Dendriten- oder Axonäste können auf diese Weise neu ausgestreckt oder zurückgezogen werden.
A) Aktivitätsbedingt können synaptische Kontaktflächen vergrößert werden oder eine Synapse kann sich teilen, um durch Bereitstellung zweier Synapsen den Kontakt zur anderen Nervenzelle zu intensivieren.
B) Die Entstehung ganz neuer Synapsen erfolgt in zwei Schritten: Der Wachstumskegel eines auswachsenden Axons nähert sich einem Dendriten und bildet einen ersten Kontakt mit ihm. Damit beginnt ein Reifungsprozess, in dessen Verlauf die notwendigen Proteine und Organellen an die Synapse rekrutiert werden und sich alle prä- und postsynaptischen Komponenten aufbauen.
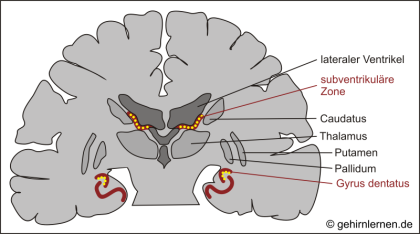
Schließlich gehört auch die Bildung neuer Nervenzellen zur strukturellen Plastizität. Zwei Gehirngebiete sind im Säugergehirn zu dieser Neurogenese fähig. Dies ist zum einen die subventrikuläre Zone, von der aus die neugebildeten Zellen in den olfaktorischen Bulb wandern, zum anderen der Gyrus dentatus der hippocampalen Formation, der im Rahmen von Lernen und Gedächtnisbildung besondere Aufmerksamkeit verdient.
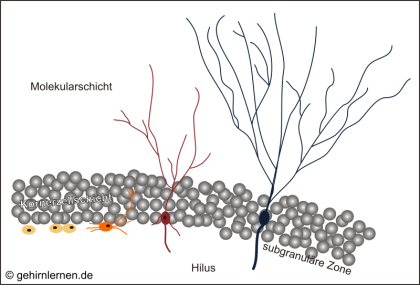
Bekanntermaßen sind Nervenzellen so weit ausdifferenziert, dass sie sich nicht mehr teilen können. Neue Nervenzellen können somit nur aus undifferenzierten Stamm- oder Vorläuferzellen hervorgehen, die im Gehirn ausschließlich in den beiden genannten Regionen vorkommen. Die Bildung neuer Nervenzellen aus Vorläuferzellen ist damit mehr als nur eine bloße Zellteilung. Der Teilung (Zellproliferation) schließt sich ein komplizierter Reifungsprozess an, der Migration, d.h. Wanderung der Zellen, Differenzierung und Integration der neu entstandenen Zelle in das vorhandene Nervennetz beinhaltet. Diese Integration ist die Voraussetzung für das Überleben einer neuen Nervenzelle, denn wird sie nicht integriert, stirbt sie wieder ab. Dieser Prozess ist in Abb. 12.6 für die Neurogenese im Gyrus dentatus einmal dargestellt.
Undifferenzierte Vorläuferzellen teilen sich (Zellproliferation, gelb), die neu entstandene Nervenzelle beginnt sich zu differenzieren (orange, rot) und wandert in die Körnerzellschicht ein (Migration, rot). Dabei beginnt sie ihre Dendriten in die Molekularschicht zu strecken und sendet ihr Axon in den Hippocampus proper. Nun muss die Zelle integriert werden, d.h. Inputs erhalten und Outputs senden können, sonst wird sie untergehen und sterben. Nach etwa 4-10 Tagen nach der Teilung erreicht das Axon sein Zielgebiet im Hippocampus proper. Nach drei Wochen verliert die Zelle ihre Teilungsfähigkeit und gilt als reifes Neuron (blau). Die Zelle ist integriert und hat überlebt. Nach 4-7 Wochen ist die neugeborene Nervenzelle nicht mehr von den anderen Körnerzellen zu unterscheiden.
Die Neurogenese im Gyrus dentatus unterliegt strengen Regulationsmechanismen, die jedoch noch nicht abschließend geklärt sind. Forscher unterscheiden dabei Mechanismen, die die Zellproliferation steuern, und solche, die das Zellüberleben bedingen, d.h. Einfluss auf Differenzierung, Migration und Integration der Zellen nehmen.
Es ist davon auszugehen, dass Regulation und Funktion eng miteinander verbunden sind. Somit erfüllen die neuen Nervenzellen höchstwahrscheinlich eine Funktion innerhalb der Langzeitgedächtnisbildung im Hippocampus. Einwachsende Nervenzellen fordern ihren Einbau und damit einen Umbau bestehender Nervennetze, der andere Formen der strukturellen Plastizität mit sich bringt: Synapsen, Axone und Dendriten müssen umgebaut werden, um die neuen Nervenzellen einzubinden. Somit kann die Neurogenese als Motor für lebenslange Plastizität im Hippocampus und damit für lebenslanges Lernen angesehen werden.
In der Tat konnte in Versuchen gezeigt werden, dass ein Unterbinden der Neurogenese zu Gedächtnisstörungen führt und Lernen selbst ebenso wie eine anregende Umgebung das Zellüberleben neugebildeter Nervenzellen fördert. Die abnehmende Fähigkeit im Alter neue Informationen aufzunehmen und zu speichern ist zudem mit einem Rückgang der Neurogenese mit dem Alter korreliert, auch wenn sie nie ganz erlischt.
Chronischer Stress hingegen wirkt sich negativ auf die Neurogenese aus. So verwundert es nicht, dass Störungen wie Depression und Burnout mit einer verminderten Neurogenese einhergehen. Der Einfluss von sportlicher Betätigung auf die Neurogenese ist noch nicht ganz geklärt. Zwar gibt es Tierstudien, die einen steigernden Effekt von Sport auf die Neurogenese gefunden haben wollen, doch dem stehen Studien entgegen, die zeigen konnten, dass dieser Effekt nur nach vorheriger Reizarmut und Isolation auftritt. Zudem steht die Frage im Raum, ob eine erhöhte Neurogenese überhaupt physiologisch sinnvoll ist. Viele Krankheiten wie die Schizophrenie gehen mit einer erhöhten Neurogenese einher. So scheint es, dass die Funktion des Hippocampus und des gesamten Gehirns am besten von einer moderaten Neurogenese profitiert.
Zusammenfassung - Ebenen der Plastizität
|
Ebene |
Prozess |
Größenordnung |
Zeitraum |
|
Synapse |
Langzeitpotenzierung |
Nano- bis Mikrometer |
Sekunden bis Stunden |
|
Neuron |
Wachstum, Neurogenese im Hippocampus |
Mikrometer |
Tage bis Wochen |
|
Kortex |
Veränderung von kortikalen Karten |
Milli- bis Zentimeter |
Monate bis Jahre |